


基于综合性转化医学研究平台,迈杰医学针对CD47抑制剂的药物提供从生物标志物检测到伴随诊断产品开发的完整解决方案。
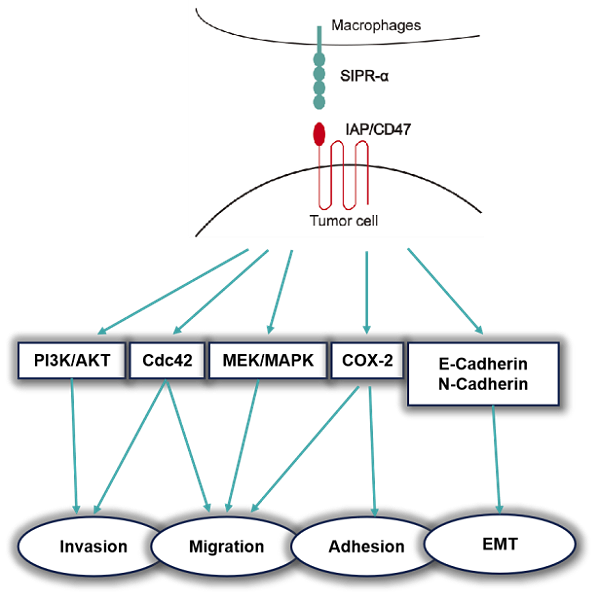
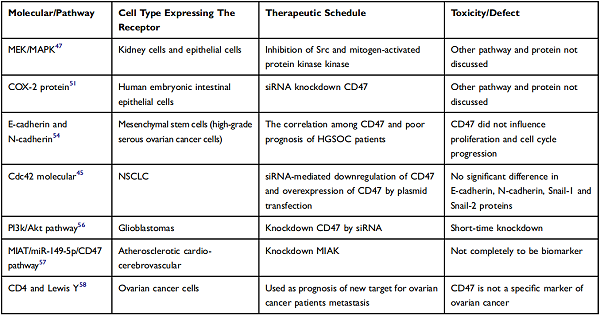
CD47属于免疫球蛋白(Ig)超家族,是一种表达于细胞表面的抑制性受体,参与多种生理过程,包括细胞增殖、凋亡、迁移和先天免疫反应。CD47 在肿瘤细胞上经常过度表达,已被确定为巨噬细胞免疫检查点,可通过结合 SIPRα(信号调节蛋白 α ,也称为 CD172a 或 SHPS-1 )在巨噬细胞吞噬癌细胞期间发送 “ 不要吃我 ” 的抑制信号,从而促进肿瘤的免疫逃逸。而SIRP-α是一种调节性膜糖蛋白,在骨髓细胞(如巨噬细胞)和其他免疫细胞(如树突细胞)中含量特别丰富 [1-2]。CD47是参与迁移过程的细胞表面分子之一,在跨内皮迁移中扮演重要角色,具有高侵袭和转移能力的癌细胞与CD47水平呈正相关 [3]。CD47相关信号通路如图1,表1所示。
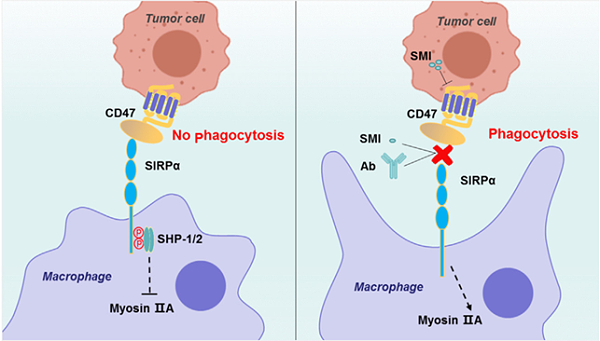
CD47在正常细胞以及癌细胞表面表达,可与巨噬细胞上的SIRPα跨膜蛋白结合形成CD47-SIRPα信号复合物,巨噬细胞利用CD47的表达来区分“自我”或“非自我”[5]。SIRPα的胞外IgV结构域与CD47结合,导致胞内ITIM基序上的酪氨酸磷酸化;SIRPα还与含有酪氨酸磷酸酶的SH2结构域结合,两种现象都抑制肌球蛋白IIA在吞噬突触中的积累,并促进释放“不要吃我”信号,从而抑制巨噬细胞介导的吞噬作用,并通过免疫系统保护正常细胞免受损伤 [6,7]。相反,当CD47的表面表达降低时(例如细胞衰老时),CD47-SIRPα信号通路减弱,巨噬细胞可以移动并吞噬这些细胞(图2)。以红细胞为例,正常红细胞上的CD47与巨噬细胞表面的SIRPα结合,产生阻止吞噬作用的抑制信号,但当红细胞衰老时,CD47的表达水平降低,CD47缺陷的衰老红细胞被视为外来客且迅速被脾脏中的巨噬细胞清除 [8-11]。CD47及其配体不仅调节免疫反应,还介导中性粒细胞趋化和神经系统发育等各种病理生理过程,并在免疫耐受和T细胞活化中发挥调节作用 [12]。
靶向CD47-SIRPα 信号在抗肿瘤治疗中的作用机制和影响如下(图3):
1. 刺激巨噬细胞对癌细胞的吞噬作用。CD47抗体、SIRPα抗体或重组SIRPα蛋白等抑制CD47-SIRPα结合物形成,导致巨噬细胞吞噬肿瘤细胞。
2. 促进适应性免疫反应。CD47抗体使树突状细胞(DC)吞噬肿瘤细胞,随后将抗原呈递给T细胞( CD4+和CD8+ ),刺激抗肿瘤适应性免疫反应。
3. 激活先天免疫反应。CD47抗体通过自然杀伤细胞(NK)介导的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)消除肿瘤细胞。
4. 诱导肿瘤细胞凋亡。例如CD47抗体通过不依赖半胱天冬酶的机制诱导细胞凋亡,以此来增加肿瘤细胞清除率。
5. 此外,阻断CD47还可能增加巨噬细胞向肿瘤的募集,抑制肿瘤细胞增殖。例如在淋巴瘤小鼠模型中,抗CD47抗体可防止淋巴瘤细胞增殖并延长生存期。
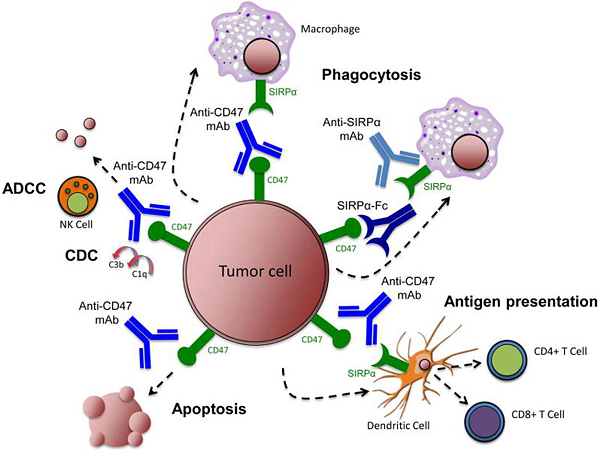
图3. Targeting the CD47-SIRPα pathway in cancer[12]
(数据来源:药渡,截止于2022年7月)

CD47药物有两种最为核心的作用机制:
1. 阻断CD47/SIRPα“别吃我”信号诱发的巨噬细胞吞噬作用;
2. 由单克隆抗体Fc端引起的传统效应功能,如ADCC和CDC作用。
这两种效应中,如果Fc端引起ADCC和CDC作用过强,那么必然会大量杀伤红细胞,造成严重的毒性问题,引发贫血和血小板减少等副作用。破坏红细胞的机制包括两种:(1)抗体与不同的红细胞偶联而引起红细胞的聚集,继发引起红细胞的破裂;(2)抗体与红细胞结合后,如果抗体是IgG1,Fc端通过与巨噬细胞的FcR结合而激活巨噬细胞对红细胞的吞噬。因此,开发过程中要特别筛选抗红细胞聚集的分子。现有的专利方法包括:A.筛选弱结合或不结合红细胞的抗体或SIRPa融合蛋白;B.采用IgG4Fc,不激活巨噬细胞;C.开发双抗,除了抗CD47外,另一抗体选择靶向TSA(肿瘤特异性抗原)的,以增加肿瘤细胞的结合,减少正常细胞的结合。
但相反,若完全摒弃Fc端介导的效应,只依赖CD47/SIRPα信号通路本身发挥的生物学功能,则并不足以激活显著的抗肿瘤应答。已有大量数据证明用IgG4替代IgG1将大幅削弱CD47单抗对于肿瘤细胞的杀伤能力。另外,T淋巴细胞也表达CD47,在筛选CD47抗体时也要考虑这因素,排除能引起T淋巴细胞凋亡的抗体。
虽然针对CD47免疫检查点的抗体已经显示出良好的抗肿瘤效果,一些已经进入III期临床试验,但开发小分子抑制剂也同样重要,因为它们比抗体具有优势。首先,小分子抑制剂不是免疫原性的,与抗体相比半衰期更短,故而副作用可控。其次,一些CD47抗体可以引起凝集,因为抗体与高密度红细胞膜决定簇(如血糖素A)结合,而小分子抑制剂可以避免这一点。此外,小分子抑制剂具有口服给药的潜力,可以改善患者的依从性。并且,小分子抑制剂体积较小,比抗体更容易渗透到细胞内,并抑制下游信号通路,阻止下游信号激活以重新刺激吞噬作用。当然,除CD47外,靶向SIRPα的小分子抑制剂亦是可行。
表3. MEDx Solution to Biomarker Exploration and Detection on anti-CD47 Treatment
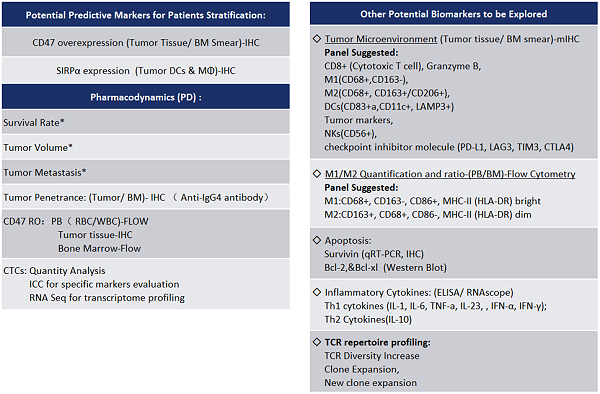
IHC平台
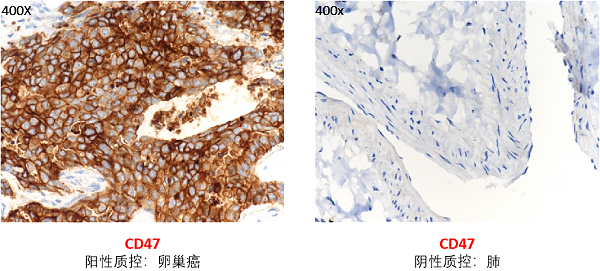
图4a. CD47 Expression in Tumor tissue
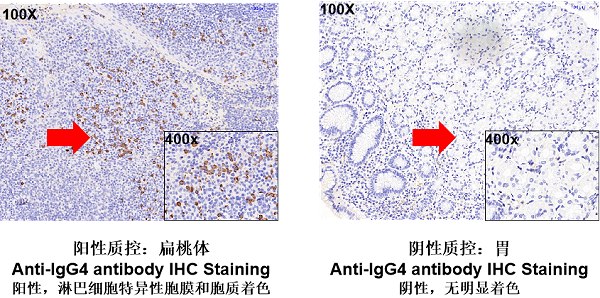

流式平台
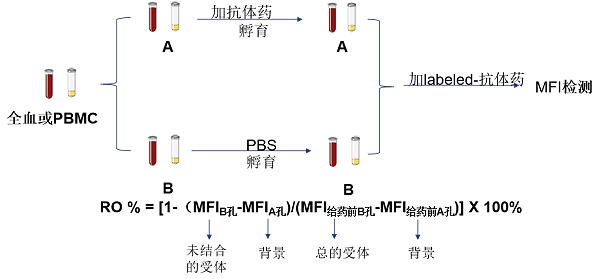
图5a. RO Evaluation with Flow Cytometry (Method 1)
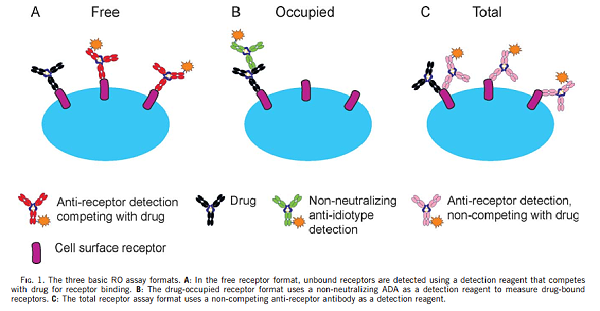
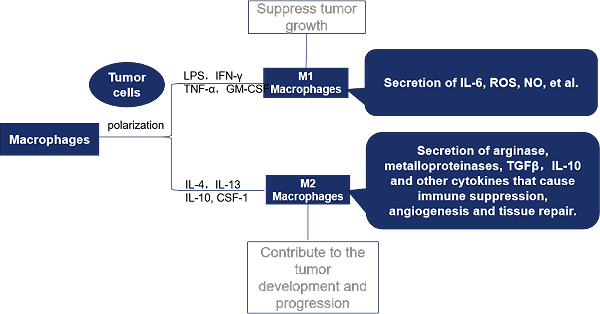
图5c. 人外周血&骨髓M1/M2巨噬细胞相关标志物检测
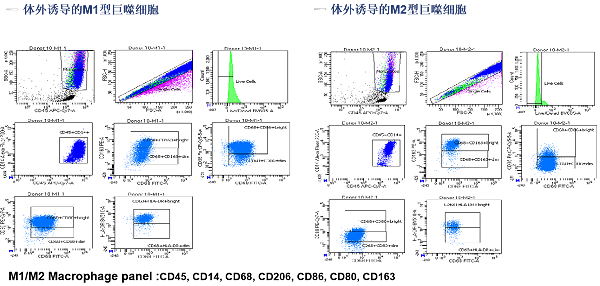
图5d. 人外周血&骨髓M1/M2巨噬细胞相关标志物检测
参考文献
[1] Murata Y, Kotani T, Ohnishi H, Matozaki T. The CD47-SIRPalpha signalling system: its physiological roles and therapeutic application[J]. Biochem, 2014, 155(6):335–344.
[2] Latour S, Tanaka H, Demeure C, et al. Bidirectional negative regulation of human T and dendritic cells by CD47 and its cognate receptor signal-regulator protein-alpha: down-regulation of IL-12 responsiveness and inhibition of dendritic cell activation[J]. Immunol, 2001, 167(5):2547–2554.
[3] Cooper D, Lindberg FP, Gamble JR, Brown EJ, Vadas MA. Transendothelial migration of neutrophils involves integrin-associated protein (CD47)[J]. Proc Natl Acad Sci USA, 1995, 92(9):3978–3982.
[4] Lian S , Xie X , Lu Y , et al. Checkpoint CD47 Function On Tumor Metastasis And Immune Therapy[J]. OncoTargets and Therapy, 2019, 12:9105-9114.
[5] Matozaki T, Murata Y, Okazawa H, Ohnishi H. Functions and molecular mechanisms of the cd47-sirpalpha signalling pathway[J]. Trends Cell Biol, 2009, 19:72–80.
[6] McCracken MN, Cha AC, Weissman IL. Molecular pathways: activating t cells after cancer cell phagocytosis from blockade of cd47 “don’t eat me” signals[J]. Clin Cancer Res, 2015, 21:3597–601.
[7] Wu L, Yu GT, Deng WW, Mao L, Yang LL, Ma SR, et al. Anti-cd47 treatment enhances anti-tumor t-cell immunity and improves immunosuppressive environment in head and neck squamous cell carcinoma[J]. Oncoimmunology, 2018, 7:e1397248.
[8] Per-Arne O. Role of cd47 and signal regulatory protein alpha (sirpα) in regulating the clearance of viable or aged blood cells[J]. Transfus Med Hemother, 2012, 39:315–20.
[9] Pan Y, Wang F, Liu Y, Jiang J, Yang YG, Wang H. Studying the mechanism of cd47-sirpα interactions on red blood cells by single molecule force spectroscopy[J]. Nanoscale, 2014, 6:9951–4.
[10] Doyen V, Rubio M, Braun D, Nakajima T, Abe J, Saito H, et al. Thrombospondin 1 is an autocrine negative regulator of human dendritic cell activation[J]. Exp Med, 2003, 198:1277–83.
[11] Burger P, Hilarius-Stokman P, de Korte D, van den Berg TK, van Bruggen R. Cd47 functions as a molecular switch for erythrocyte phagocytosis[J]. Blood, 2012, 119:5512–21.
[12] Zhang W , Huang Q , Xiao W , et al. Advances in Anti-Tumor Treatments Targeting the CD47/SIRPα Axis[J]. Frontiers in Immunology, 2020, 11.
[13] Yu WB , Ye ZH , Chen X , et al. The development of small-molecule inhibitors targeting CD47[J]. Drug Discovery Today, 2020, 26(2).
本文标签: 药物临床前服务 药物临床前研发服务 靶向药伴随诊断 核酸检测多少钱 生物标志物分析