


蛋白酪氨酸激酶7(Protein tyrosine kinase 7,PTK7)是一种多功能调节因子,参与胚胎生成管形成和各种干细胞功能。 除了在胚胎发生和干细胞功能中具有重要作用,PTK7与肿瘤的发生、发展和浸润有关,在多种癌症中均出现高表达, 且与患者预后差有关[1] 。鉴于PTK7的重要生物学意义,其研究受到了科学家们的高度重视。迈杰转化医学研究(苏州)有限公司(以下简称“迈杰医学”)拥有综合性转化医学研究平台,在靶向药物临床研究方面已积累丰富经验,从生物标志物检测至伴随诊断产品开发,可为合作伙伴提供靶向PTK7药物的全面研究新策略。
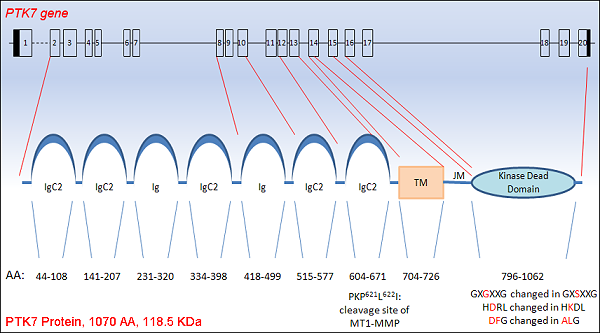
PTK7结构
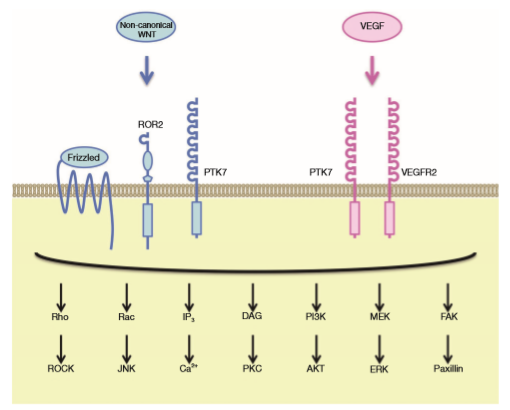
PTK7信号通路
PTK7位处WNT信号、VEGF信号和干细胞生物学的十字路口,其在各类癌症中的参与作用已经被研究。PTK7是WNT家族配体的共受体,可以将WNT信号类转换为非典型的WNT/PCP信号级联。作为一种重要的跨膜受体蛋白,PTK7参与Wnt和VEGF信号通路的调节,影响着细胞的极性、运动、迁移和侵袭、组织再生和伤口愈合等 [4] 。
PTK7在正常 上皮、内皮和造血组织中普遍低水平表达,在大多数正常组织中保持阴性。
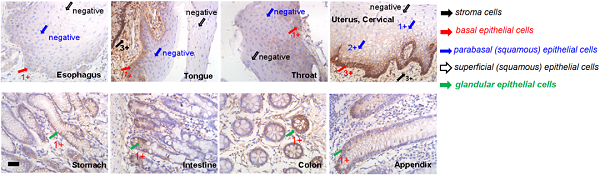
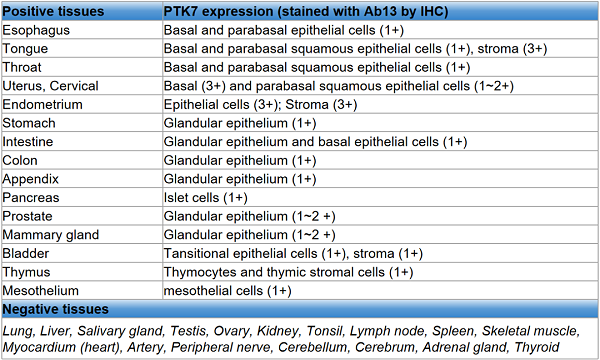
表1. PTK7在人体正常组织中的表达汇总[5]
自首次在黑素细胞中被发现后,PTK7 陆续在多种上皮癌,肉瘤以及血液癌症中被检测出,其过表达状态与不良预后相关。有研究发现, PTK7 在乳腺癌、卵巢癌和肺癌中的表达率可高达 50% 以上 [6] 。
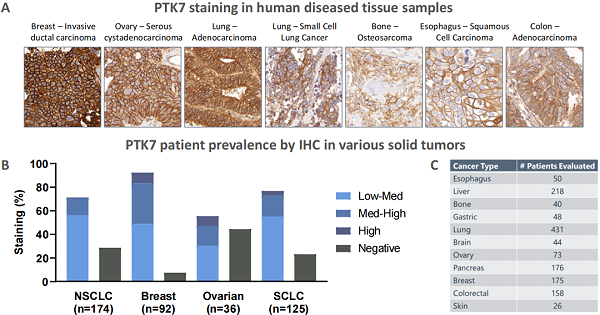
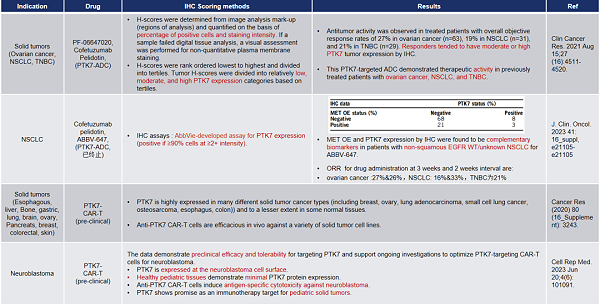
表2. PTK7在肿瘤组织中的IHC表达汇总-1
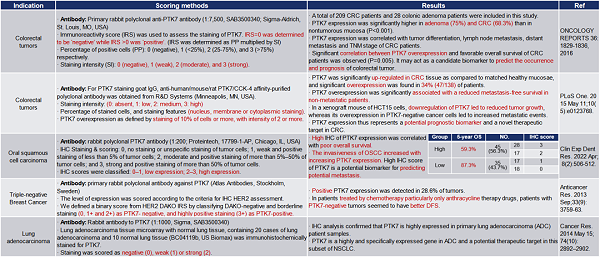
表2. PTK7在肿瘤组织中的IHC表达汇总-2
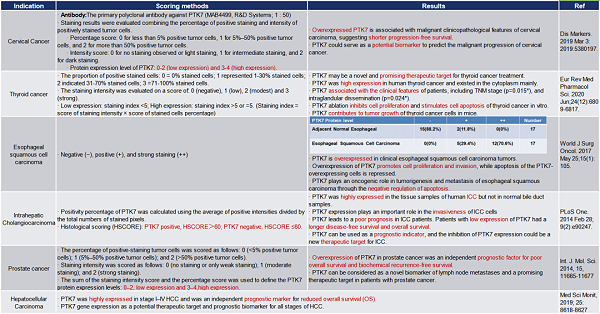
表2. PTK7在肿瘤组织中的IHC表达汇总-3
当前,全球尚无PTK7 靶向药物获批上市。由药渡网公布的信息可知,PTK7 在研药物有 ADC 、 CAR-T 、纳米抗体等类型, 大多药物处于临床前 阶段。
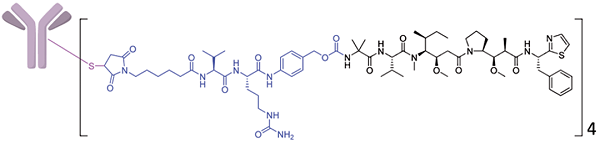
图5. PF-06647020结构
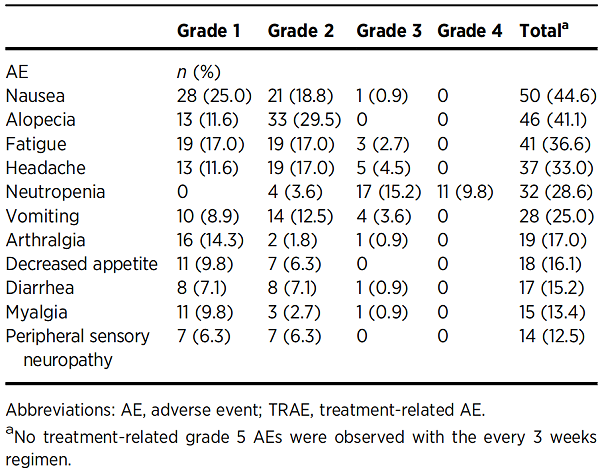
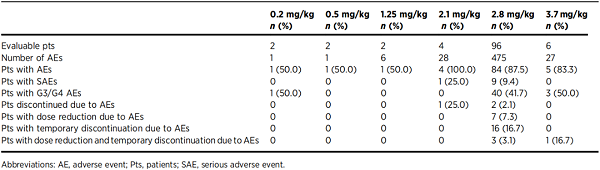
表5. Summary of TRAEs by dose level with every 3 weeks dosing of PF-06647020 (all cycles, N=112)[7]
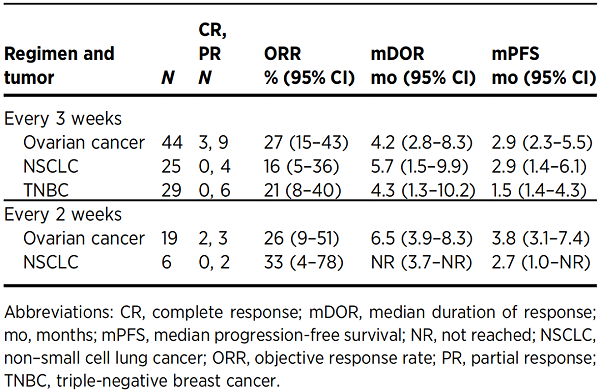
表6. Antitumor activity of PF-06647020 administered every 3 weeks or every 2 weeks in patients with advanced ovarian cancer, NSCLC, or TNBC[7]
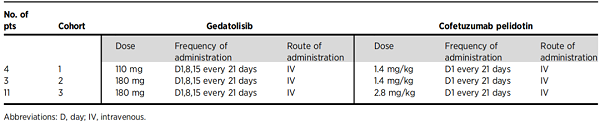
表7. Treatment plan [8]
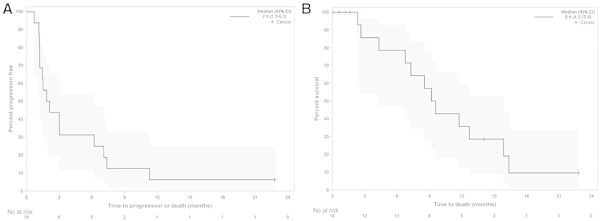
图6. Kaplan–Meier plot of PFS & OS [8]
今年10月,普众发现在MOLECULAR CANCER THERAPEUTICS期刊发表了新型PTK7 ADC——MTX-13的研究进展。MTX-13表现出PTK7特异性的细胞结合、有效的内化和体外释放,通过DNA损伤和凋亡诱导引起细胞毒性活性,并具有强烈的旁观者杀伤作用。 PTK7被证明是小细胞肺癌中的一个可操作的靶点,其中MTX-13显示出完全和持久的应答。由于PTK7在来自不同解剖部位的鳞状细胞癌中持续过表达,MTX-13在这组异质性肿瘤中的强效力提示了一种常见的治疗策略。同时,MTX-13在原位结肠癌异种移植模型中抑制了肿瘤的生长和转移。

图7. MTX-13阶段性研究结果 [5]
结果表明,MTX-13有能力克服肿瘤耐药性,并具有抑制PTK7阳性肿瘤转移的潜力。 由于高度阳性过表达及其在肿瘤发展和转移中的作用,PTK7是一个很有吸引力的泛肿瘤治疗靶点。PF-06647020的临床疗效证明了PTK7有潜力作为一种有效的治疗靶点,而MTX-13有潜力在临床试验中表现超过它,并扩大PTK7阳性肿瘤的治疗机会 [5] 。
在2023年AACR年会上,百奥赛图公布了BCG033的研究进展。BCG033是由RenLite ® 平台产生的一种新型双特异性PTK7和TROP2抗体药物偶联物,该抗体包含完整的人重链免疫球蛋白可变结构域和一个共同的人kappa轻链,用于随后的双特异性抗体组装。
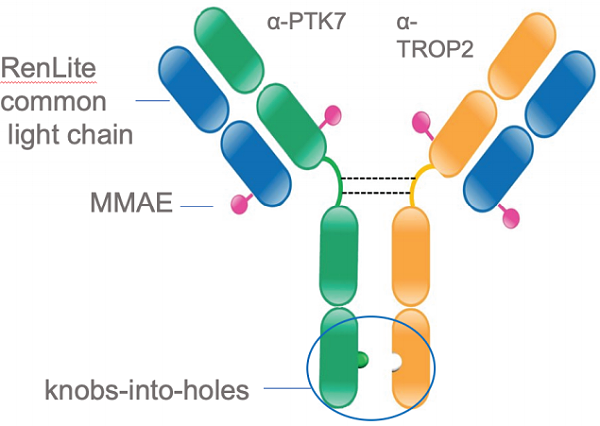
图8. BCG033-BsADC [9]
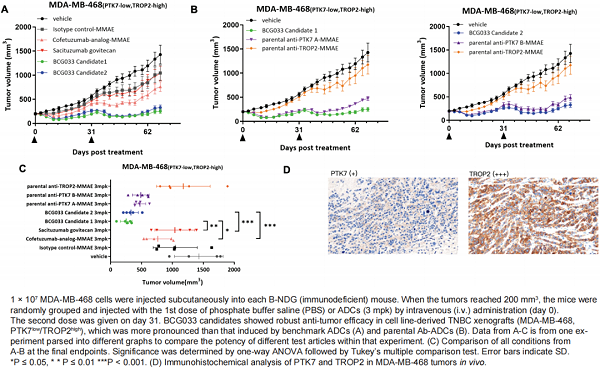

结果显示,PTK7/TROP2在多种实体瘤中共表达,提示BCG033在多种实体肿瘤中具有发挥抗肿瘤作用的潜力 [9] 。
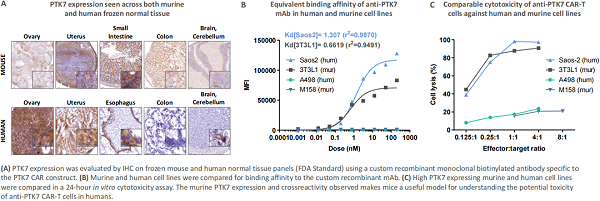
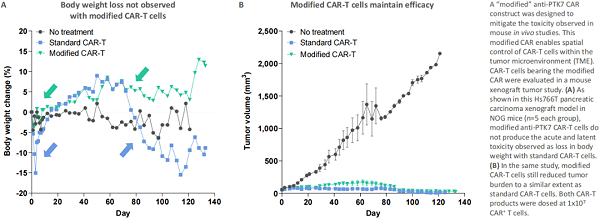
CRISPR Therapeutic 公司在 2020 年 AACR 年会上介绍了一款同种异体抗 PTK7 CAR-T 细胞,该 CAR-T 在体外和体内异种移植模型(乳腺癌、肺癌、结肠癌、胰腺癌和卵巢癌)中显示出药效。 但在体内观察到急性和潜在毒性,即注射后不久,在异种移植模型中观察到小鼠体重下降又迅速恢复到基线以上,还观察到动物模型更多的潜在毒性,且差异较大。
[1] Shin WS, Kwon J, Lee HW, Kang MC, Na HW, Lee ST, Park JH. Oncogenic role of protein tyrosine kinase 7 in esophageal squamous cell carcinoma. Cancer Sci. 2013 Aug;104(8):1120-6.
[2] Chen
G, Qi S, Yang X, Chen W. Prognostic significance of PTK7 in human malignancies.
Histol Histopathol. 2018 Apr;33(4):379-388.
[3] https://atlasgeneticsoncology.org/gene/41901/
[4] Katoh
M. Antibody-drug conjugate targeting protein tyrosine kinase 7, a receptor tyrosine
kinase-like molecule involved in WNT and vascular endothelial growth factor
signaling: effects on cancer stem cells, tumor microenvironment and whole-body
homeostasis. Ann Transl Med. 2017 Dec;5(23):462.
[5] Kong
C, Pu J, Zhao Q, Weng W, Ma L, Qian Y, Hu W, Meng X, Meng T. MTX-13, a Novel
PTK7-Directed Antibody-Drug Conjugate with Widened Therapeutic Index Shows
Sustained Tumor Regressions for a Broader Spectrum of PTK7-Positive Tumors. Mol
Cancer Ther. 2023 Oct 2;22(10):1128-1143.
[6] https://doi.org/10.1158/1538-7445.AM2020-3243
[7] Maitland
ML, Sachdev JC, Sharma MR, Moreno V, Boni V, Kummar S, Stringer-Reasor E,
Lakhani N, Moreau AR, Xuan D, Li R, Powell EL, Jackson-Fisher A, Bowers M,
Alekar S, Xin X, Tolcher AW, Calvo E. First-in-Human Study of PF-06647020
(Cofetuzumab Pelidotin), an Antibody-Drug Conjugate Targeting Protein Tyrosine
Kinase 7, in Advanced Solid Tumors. Clin Cancer Res. 2021 Aug
15;27(16):4511-4520.
[8]
Radovich M, Solzak JP, Wang CJ, Hancock BA, Badve S, Althouse SK, Bray SM, Storniolo
AMV, Ballinger TJ, Schneider BP, Miller KD. Initial Phase I Safety Study of
Gedatolisib plus Cofetuzumab Pelidotin for Patients with Metastatic
Triple-Negative Breast Cancer. Clin Cancer Res. 2022 Aug 2;28(15):3235-3241.
[9] https://doi.org/10.1158/1538-7445.AM2023-LB216
本文标签: 药物临床前服务 药物临床前研发服务 靶向药伴随诊断 核酸检测多少钱 生物标志物分析