


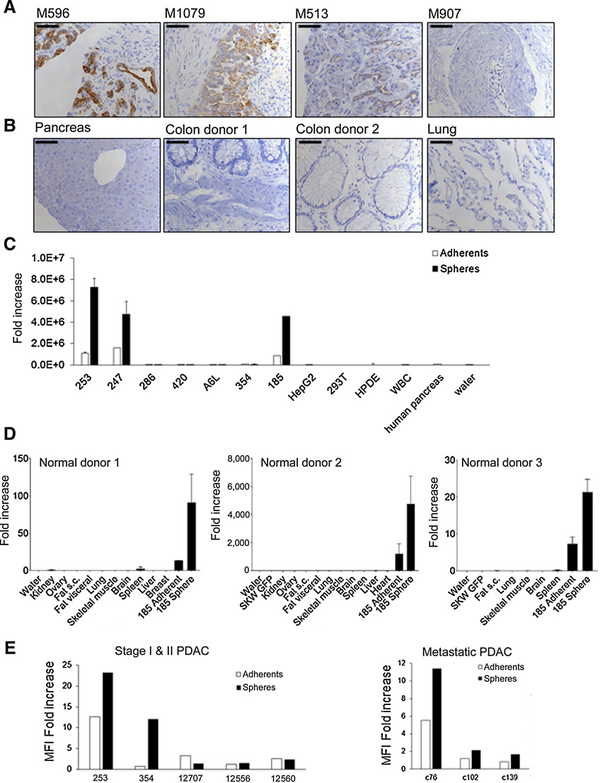
图1 CEACAM7在PDAC肿瘤组织和正常组织中的表达开发靶向CEACAM7的
新型2869 CAR-T细胞本文进一步研究2869杂交瘤细胞对CEACAM7的特异性。354和c102 PDAC培养物在贴壁培养时未检出CEACAM7表达(图1E),对354和c102 PDAC培养物进行修饰来表达GFP和荧光素酶(354GL和c102GL),以便在体内和体外进行跟踪。为了评估2869抗体对CEACAM7蛋白的特异性,本文进一步修饰354GL和c102GL细胞来稳定表达CEACAM7。2869杂交瘤细胞上清的Western
blotting结果显示CEACAM7成功异位表达,且CEACAM7在c102GL中的表达高于354GL(图2A)。本文基于2869 抗体的重链和轻链的可变区生成了一个 scFv,将2869 scFv-Fc融合体转染到293T细胞中,用含有分泌蛋白的上清液在修饰和未修饰的354GL上进行流式细胞术检测,结果显示2869 scFv - fc显示了与2869杂交瘤上清相似的结合模式,2869 scFv-fc与异位表达CEACAM7的细胞特异性结合,证明了2869 scFv可用于开发靶向CEACAM7的CAR-T细胞(图2D)。通过将2869单链抗体与铰链结构域和CD8a跨膜结构域融合,在CD137(4-1BB)共刺激结构域和CD3z激活结构域的框架内构建第二代嵌合抗原受体,一些研究表明表位结合域与T细胞表面的距离可以显著影响CAR-T细胞的功能,因此,本文针对CEACAM7蛋白的抗体的一部分结构制造出了两种新型CAR,一个有45个氨基酸CD8α衍生铰链,一个有12个氨基酸IgG4衍生铰链
(图2E),两种CAR都可以有效地转导到人类T细胞中,表达量在40%到90%之间。
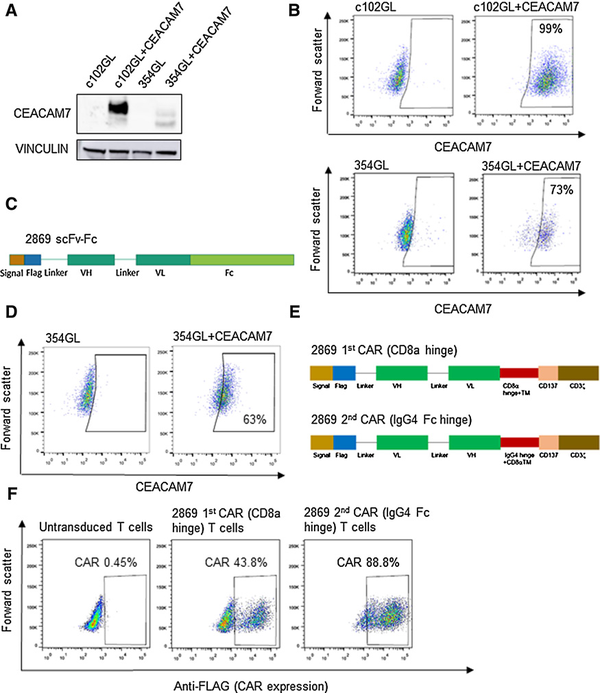
图2 开发新型的2869 CAR-T细胞2869 CAR-T细胞靶向CEACAM7的特异性制造出了新型的CAR细胞,随后修饰杀伤性T细胞使其能够在表面上展现新型的CAR蛋白来识别并结合CEACAM7,并能够指挥杀伤性T细胞杀灭仅携带CEACAM7的细胞。为了研究2869 CAR对CEACAM7靶点的特异性和疗效,将CEACAM7异位表达的354GL细胞和c102GL细胞作为CAR-T细胞的靶点,未修饰的细胞作为阴性对照。未修饰的T细胞或修饰后表达2869
CARs的T细胞,以5:1的E:T比例覆盖在PDAC靶细胞的单层上。通过GFP表达来评估靶细胞的活力。与2869 CAR-T 细胞类型中的任一种共培养后,观察到 CEACAM7 表达的靶PDAC细胞裂解,但未修饰的细胞未观察到裂解(图3A和B)。WST-1对靶细胞定量结果显示2869 CAR-T细胞对未修饰的PDAC细胞没有任何影响,当E:T比例为5:1和1:1时,CEACAM7表达的靶细胞活力降低。而细胞毒性杀伤似乎与抗原密度相关,c102GL的细胞毒性高于354GL细胞,这与c102GL细胞中CEACAM7表达较高一致。当CAR
- T细胞以E:T为5:1比例应用于任一靶细胞类型时,较小的2869 CAR细胞 (IgG4铰链)具有轻微但显著较高的细胞毒性功效(图3C和D)。说明2869 CAR-T细胞有效靶向表达CEACAM7的贴壁生长的PDAC细胞——354GL细胞和c102GL细胞,而对不表达目标抗原的细胞没有影响。
为检验T细胞穿透肿瘤微环境屏障的能力,将表达CEACAM7或不表达CEACAM7的354GL和c102GL细胞进行球体培养7天,然后以E:T为5:1添加效应T细胞,结果发现添加2869
CAR-T细胞后,表达CEACAM7的球形培养物完全溶解,而未修饰的不受影响。因此,研究表明2869 CAR-T细胞可以靶向表达CEACAM7的PDAC球体培养物,在体外条件下富集CSC并再现基质屏障。同时发现2869 CAR-T细胞在贴壁或球形培养下被目标抗原特异和有效地激活。

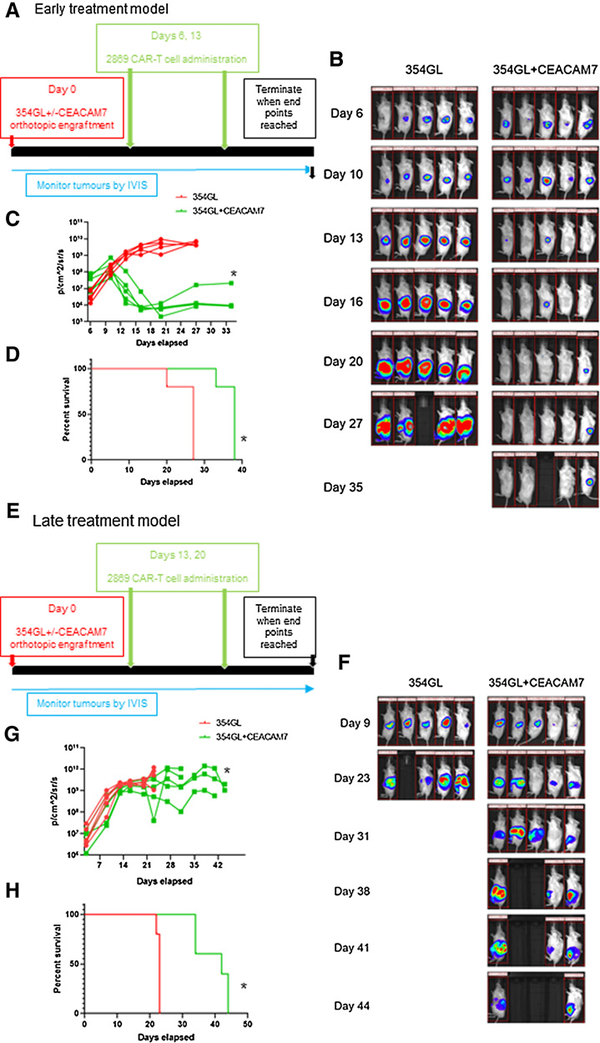
为了评估CAR-T细胞活性是否在体内持续存在,本研究原位植入354GL细胞,构建了I/II期PDAC异种移植模型,此模型肿瘤移植并迅速扩张,并在肿瘤植入后第6天和第13天给予两剂2869 CAR-T细胞治疗(图4A),在354GL队列中,肿瘤持续快速发展,所有小鼠在第23天肿瘤负荷明显。在354GL±CEACAM7队列中,肿瘤显著消退,5只小鼠中有4只小鼠的肿瘤被完全清除(图4B和C),然而该队列中的所有动物都死于移植物抗宿主病(GvHD),并在第38天实施安乐死(图4D)。为了研究2869
CAR-T细胞对更大、更成熟肿瘤的疗效,本文采用354GL±CEACAM7细胞建立了第二种异种移植模型,并监测了肿瘤在体内生长的情况,当肿瘤达到一定大小时,在第13天和第20天注射了两剂2869 CAR-T细胞(图4E),354GL组的所有动物迅速死亡,而354GL±CEACAM7组的5只动物中有4只动物观察到肿瘤稳定且生存时间被延长(图4F和G),说明了2869 CAR-T细胞对来自患者原发性PDAC培养的异种移植模型具有体内抗原特异性。
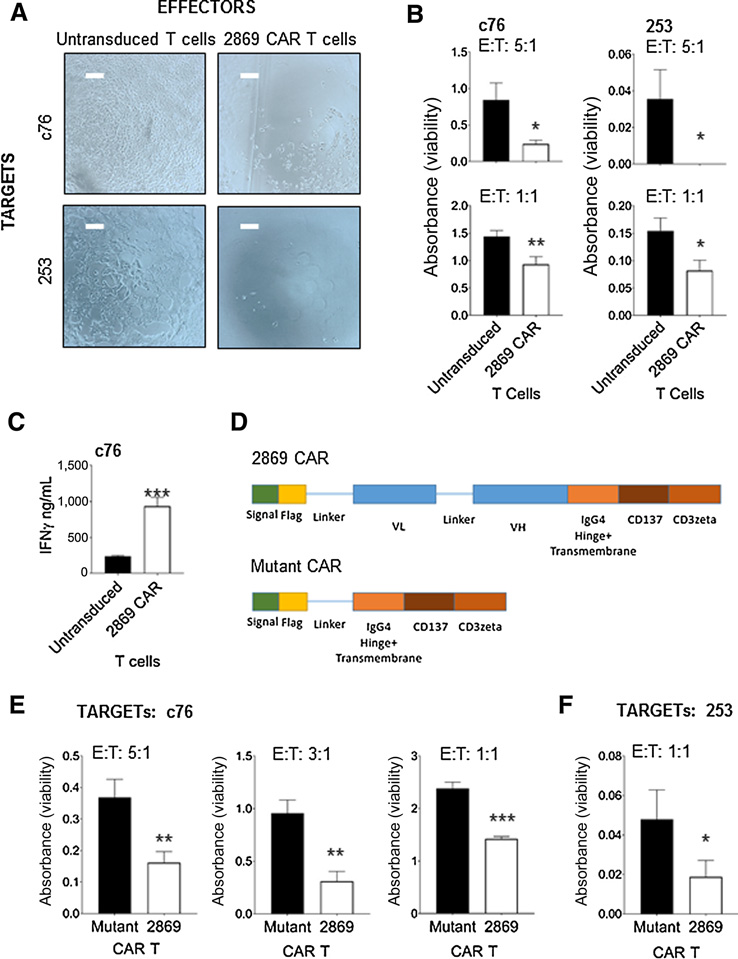
表达的肿瘤细胞患者来源的PDAC细胞系c76和253细胞在贴壁培养时CEACAM7的表达水平低于球体培养细胞(图1E),因此贴壁培养的c76和253细胞用来评估2869 CAR对内源性CEACAM7表达的活性。研究发现2869 CAR-T细胞使c76和253细胞单层裂解,而未修饰的T细胞则没有影响(图5A)。WST-1靶细胞定量结果显示2869 CAR-T细胞以效应细胞剂量依赖的方式裂解两种靶细胞,观察到E:T比例为
5:1比E:T比例为 1:1有更高的细胞毒性(图5B)。同时2869 CAR-T细胞与靶细胞PDAC共培养时,观察到IFNg分泌增加(图5C)。因此本文构建了一个具有类似细胞内共刺激和激活域的突变型CAR,但缺乏scFv表位结合域(图5D)。与突变的CAR-T细胞相比,使用PDAC 253靶标的细胞毒性显示2869 CAR-T细胞具有显著的靶向裂解作用,表明2869 CAR-T细胞对CEACAM7具有特异性靶向作用(图5F)。
为了研究CEACAM7在更多细胞系中的表达,研究者构建了6个PDAC细胞系,显示2869CAR-T细胞与所有细胞类型结合,与PDAC c76培养物的表达水平相似,低于修饰后的354GL细胞中CEACAM7的异位表达水平 (图6A和B)。同时发现CEACAM7在PDAC细胞系和原代培养细胞中均表达,在细胞表面表达水平相似。为了进一步验证2869 CAR的特异性,将354GL±CEACAM7与突变的CAR - T细胞或2869 CAR - T细胞共培养,E:T比例为3:1。显微镜和WST-1靶细胞定量结果证实2869
CAR - T细胞能够特异性靶向CEACAM7表达的肿瘤细胞,而突变的CAR-T细胞对抗原表达或不表达的细胞系没有影响(图6C)。进一步使用2869 CAR-T和突变的CAR-T细胞作为对照,对所有6个PDAC细胞系进行了细胞毒性试验。在E:T比为3:1和1:1时,所有PDAC细胞系与2869 CAR-T细胞共培养时均观察到显著的细胞毒性。细胞毒性与PDAC原代培养物的细胞毒性相当,但比异位表达354GL±CEACAM7的细胞低(图6D和E)。这些数据进一步证明了2869 CAR-T细胞对CEACAM7表达的PDCA培养细胞的特异性。
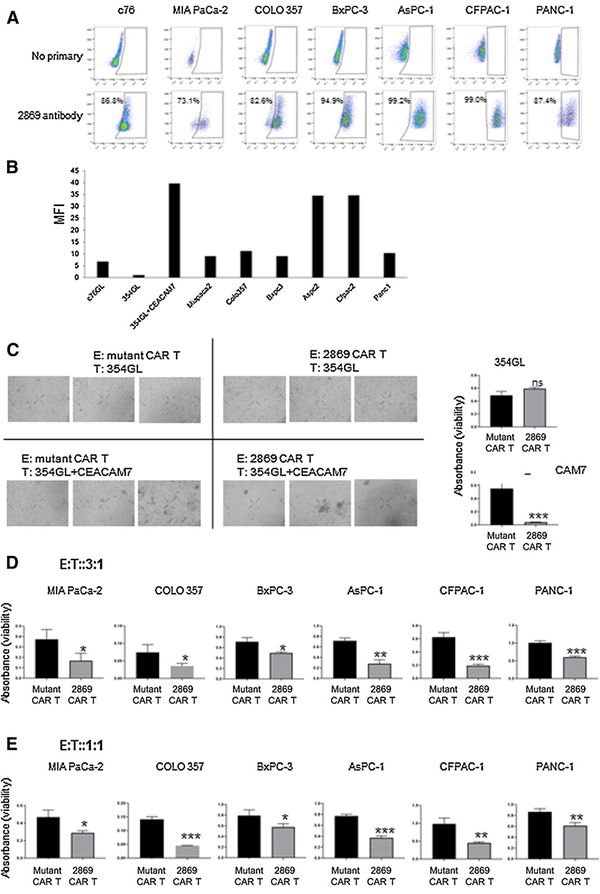
图6 2869 CAR - T细胞靶向CEACAM7表达的PDCA细胞系2869CAR-T细胞可延缓PDCA患者来源的异种移植瘤的生长将贴壁培养的PDAC c76GL细胞原位植入NSG小鼠。细胞取自于患有转移性晚期PDAC患者的血液,具有侵袭性强、生长快速且广泛转移特点。监测肿瘤大小达到>0.5 cm3,并且出现可检测的转移,来准确模拟人类患者晚期疾病表现。在这个阶段,给动物注射5*106突变的CAR-T细胞或2869
CAR-T细胞(图7A)。使用突变的CAR-T细胞治疗的5只动物全部观察到肿瘤持续发展,2869 CAR-T细胞治疗的5只动物中只有2只观察到肿瘤的持续发展。在2869 CAR-T细胞队列的应答动物中观察到原发肿瘤和肝转移完全消退(图7B和C)。同时发现2869 CAR-T治疗组的总生存期明显优于突变的CAR-T治疗组。因此,这些结果表明2869 CAR-T细胞可延缓患者来源的异种移植瘤的生长,在侵袭性和转移性的异种移植模型中引起大肿瘤和转移的完全消退。
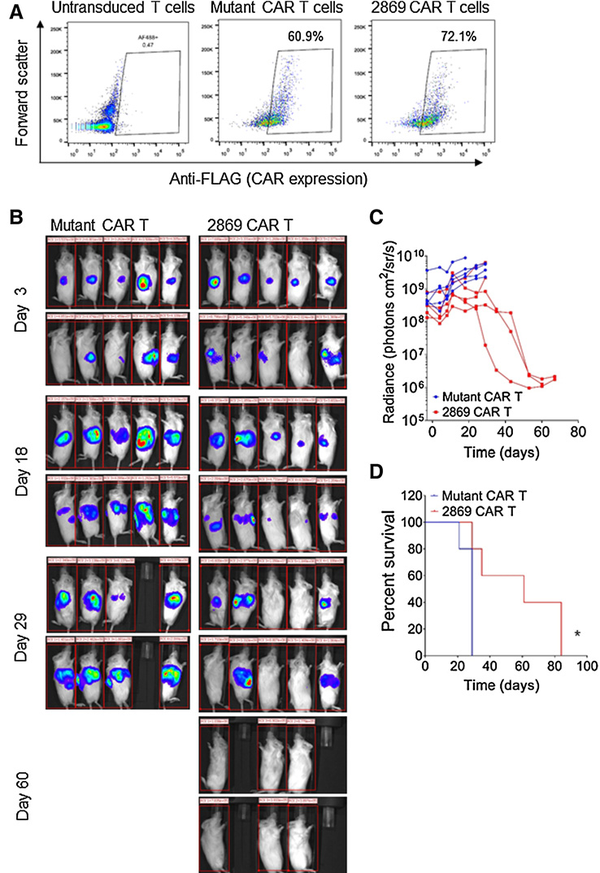 图7
图7 图7 2869 CAR - T细胞在体内靶向弥散性异种移植肿瘤结论本研究表明CEACAM7确定为PDAC的潜在安全治疗靶点,而且构建了靶向CEACAM7的CAR-T细胞,并通过体外和体内模型评估CEACAM7 CAR-T细胞的抗肿瘤疗效。靶向CEACAM7的CAR-T细胞能够靶向抗原表达的胰腺癌细胞,而对非肿瘤组织没有明显的毒性,并可延缓患者来源的异种移植瘤的生长。
迈杰转化医学为精准医疗提供生物标志的发现和验证、新药临床试验病人的分子检测和入组筛选、检测方法开发及伴随诊断试剂盒商业化等一体化解决方案。凭借核酸、蛋白、细胞等转化医学全平台的布局,可为CAR-T、TCR-T、CAR-NK等细胞治疗药物临床试验提供生物标志物检测,如药代动力学、药效学、免疫原性、外源基因整合位点等检测。有相关检测服务需求,欢迎垂询洽谈合作!更多信息,欢迎咨询400-007-1121或MARKETING@MEDxTMC.com。
参考文献:
Raj D, Nikolaidi M, Garces I, et al. CEACAM7 Is an Effective Target for CAR T-cell Therapy of Pancreatic Ductal Adenocarcinoma. Clinical Cancer Research. 2021.
内容:市场部 许晓雪编辑:Sally校正:Chao.Z/Grace/Sally
本文标签: 药物临床前服务 药物临床前研发服务 靶向药伴随诊断 核酸检测多少钱 生物标志物分析