


同源重组修复(Homologous Recombination Repair,HRR)和多聚ADP-ribose聚合酶(Poly ADP-ribose Polymerase,PARP)修复,是两种重要的DNA损伤修复机制,分别参与DNA双链和单链损伤修复。HRR通路中的BRCA1/2等基因突变会导致同源重组缺陷(Homologous Recombination Defect,HRD)。PARP抑制剂可抑制肿瘤细胞的DNA单链损伤修复,存在HRD的肿瘤细胞DNA双链修复机制异常,从而产生“合成致死”效应。迈杰致力于转化医学服务和伴随诊断产品开发及商业化,为解决创新药物研发痛点以及患者用药痛点提供全新的整体解决方案。
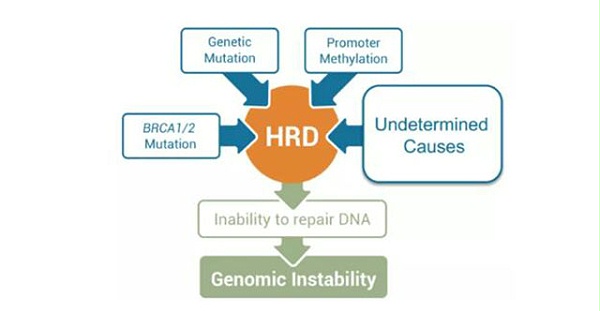
DNA损伤反应(DDR)是细胞对外源性和内源性基因毒性损伤的反应,可产生DNA单链断裂(SSB)和DNA双链断裂(DSB)。单链断裂可通过核苷酸切除修复(NER)、碱基切除修复(BER)或错配修复(MMR),双链断裂修复是通过同源重组(HR)机制。单链断裂(SSB)主要由PARP参与修复;双链断裂修复主要由BRCA1/2参与的同源重组修复(HRR)及非同源末端连接(NHEJ)。导致HRD的原因是多方面的,目前已知的原因除了BRCA1/2基因发生突变外,BRCA1启动子甲 基化、HRR其他基因突变如PALB2, CDK12,RAD51, CHEK2, ATM等以及外界因素导致的BRCA基因表达下调都会导致HRD。
PARP抑制剂是第一种成功利用合成致死概念获得批准临床使用的抗癌药物。目前FDA和NMPA批准了多款PARP抑制剂,适用于携带有害BRCA1/2基因突变或有害或可能有害的HRR基因突变的卵巢癌,输卵管癌,腹膜癌,乳腺癌,胰腺癌和转移性去势抵抗性前列腺癌(mCRPC)成人患者。
虽然目前公认的、证据较全的HRD生物标记物是胚系BRCA1/2致病突变,仅仅用BRCA1/2作为HRD的划分标准是不足够的,因为HRR涉及的数十个基因的异常也可能导致HRD表型。而综合BRCA1/2和其他HRR相关基因的检测作为PARP抑制剂疗效预测标志物的指导作用在临床实践中日渐凸显。不同癌种中HRD情况会普遍存在),相比BRCA1/2, HRD检测评估大大扩展了PARP抑制剂的受益人群。
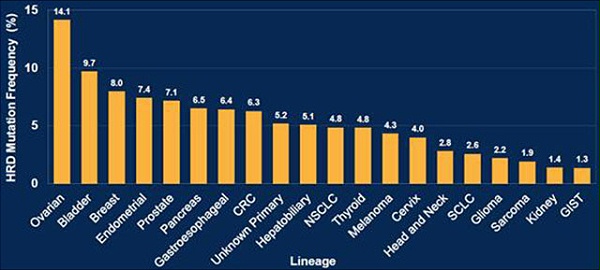
以22个HR基因发生病理型突变为衡量标准,发表在ASCO 2017的研究统计了实体瘤HRD变异频率。13.0%实体瘤存在HR基因变异,其中变异水平较高的包括卵巢癌14%,膀胱癌 (9.7%), 乳腺癌(8.0%), 子宫内膜癌(7.4%), 前列腺癌(7.1%), 和胰腺癌 (6.5%)。变异频率最高的基因是PTEN(5.8%), BRCA2 (2.8%), BRCA1 (2.6%), 和ATM (1.2%) 。
HRD检测评估
2020年NCCN指南中,推荐了所有复发或未控的患者在开始治疗前进行基因检测,检测包括:BRCA1/2、同源重组修复缺陷(HRD)有关基因和微卫星不稳定性(MSI)相关基因。2020年中国前列腺癌患者基因检测专家共识,上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识等,也将HRD作为治疗相关的重要生物标志物。FDA和EMA也批准了一些伴随诊断产品作为PARP抑制剂的疗效评估手段。
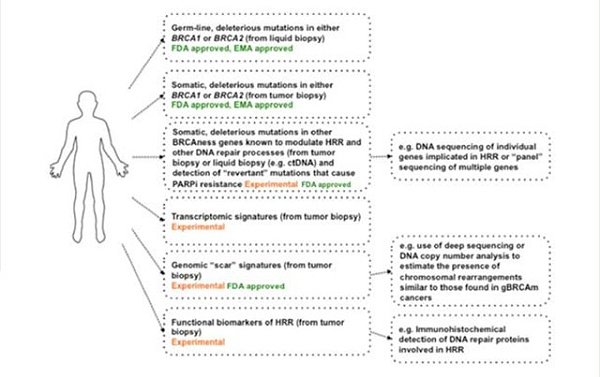
FDA和EMA批准胚系或体系BRCA1/2变异检测作为PARPi伴随诊断,HRR和其它与DNA修复相关基因检测也从探索性研究获FDA批准伴随诊断走到临床实践中。此外,转录组评估,基因组杂合性缺失和HRR基因的功能性探索也都作为HRD状态评估的方式被应用于临床研究。
HRD主要评估方法
目前HRD检测经过临床验证且获FDA批准的有两个产品,Myriad myChoice CDx(Myriad Genetics)和FoundationFoucusTM CDx BRCA LOH(Foundation Medicine)(FDA批准用于检测gLOH),分别检测组织HRR基因突变及血液gBRCA1/2基因突变和gLOH。
1.HRR相关基因突变
HRR信号通路常见的基因有BRCA1,BRCA2,ATM,BARD1,BRIP1,CDK12,CHEK1,CHEK2,FANCL,PALB2,RAD51B,RAD51C,RAD51D,RAD54L。
HRR信号通路还有其它数个基因,但目前与PARPi的相关性还有待更多研究证据的证实。相信随着更多研究数据的获得和真实世界研究进展,评估哪些HRR相关基因会对治疗评价更有意义将有更加确切的范围。
2.基因组不稳定性
基因组杂合性缺失(Loss of heterozygosis, LOH)是基因组损伤的一个标志,检测基因组范围内的杂合性缺失(gLOH, genomic LOH)的比例可以反映HRD状态,进而预测对PARP抑制剂治疗的敏感性。以FoundationFoucusTM CDx BRCA LOH为例,F1CDx通过3500个SNP,计算发生LOH的片段占整个基因组的比例,BRCA1/2突变阳性和/或LOH≥16即判定为HRD阳性。
跨端粒等位基因不平衡(Telomeric-allelic imbalance, TAI)和大片段颠换(Large-scalestate transitions, LST)也是基因组不稳定性的两个标志,同样能够反映HRD状态。基因组不稳定性状态评分可以通过对LOH、LST、TAI的综合打分来评价,计算三种不稳定性事件在基因组中出现的数量。Myraid HRD检测产品即对BRCA1/2和LOH、LST、TAI打分进行综合评价,BRCA1/2突变阳性和/或三种评价结果的打分之和≥42 即被视为HRD阳性。
3. DNA损伤修复系统通路相关基因
除HRR之外,DNA损伤修复系统(DNA Damage Response or DNA Damage Repair,DDR)通路基因有复杂的交互作用。DDR系统中包括几个重要的通路:错配修复通路(MismatchRepair,MMR),碱基切除修复(BaseExcision Repair,BER),核苷酸剪切修复通路(Nucleotide Excision Repair,NER),同源重组修复通路(Homologous Recombination Repair,HRR),非同源末端连接通路( Nonho-mologous End-joining,NHEJ)等,参与这些通路的许多蛋白质直接或间接影响其他的DNA修复通路。DNA修复蛋白通常的作用机制并不明确,而且在肿瘤发生时可以发生改变。
目前已知DNA错配修复通路(Mismatch Repair,MMR)基因缺陷可以帮助预测ICB(免疫检查点抑制剂)的临床获益,评估MMR蛋白的表达水平或者MMR基因缺陷也在PARPi研究中有应用。
由于不同DDR途径之间的相互作用,不同DDR通路对HRD的贡献权重还没有很好地建立,不同通路或基因的共突变对HRD的贡献也需要更多研究支持。
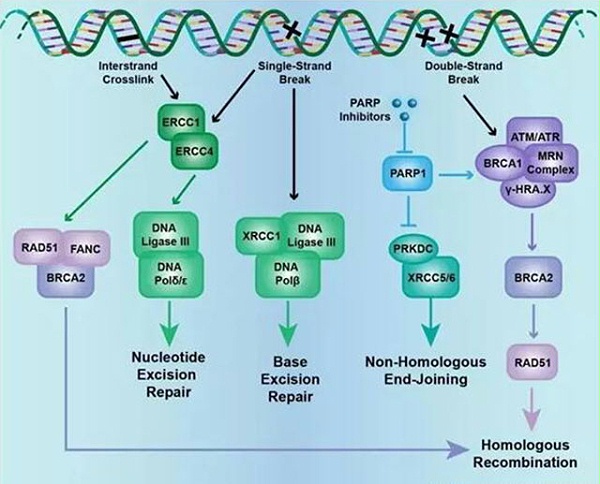
目前能够明确DDR系统中的基因功能性突变降低了基因组的稳定性,但还不清楚DDR通路对基因组稳定性的贡献权重以及通路之间的相互作用如何影响临床研究结果,期待更多的前瞻性研究。
迈杰致力于提供伴随诊断开发及商业化一体化解决方案,拥有专职产品开发团队及完善的产品研发流程,与国内外药企展开广泛合作,针对肿瘤靶向治疗、免疫治疗和细胞治疗进行新靶点和伴随诊断产品的开发。目前,公司已有多个诊断产品上市,另有数个伴随诊断产品已进入临床试验或申报阶段。